Mae'r ddau cyfansoddion cemegol gan fod elfennau cemegol yn cynnwys moleciwlau, ac mae'r rhain yn eu tro yn cynnwys atomau. Mae'r atomau'n parhau i fod yn unedig diolch i ffurfio'r hyn a elwir cysylltiadau cemegol.
Mae'r nid yw bondiau cemegol i gyd yr un peth: yn y bôn maent yn dibynnu ar nodweddion electronig yr atomau dan sylw. Mae dau fath mwyaf cyffredin o gyswllt: bondiau ïonig a'r bondiau cofalent.
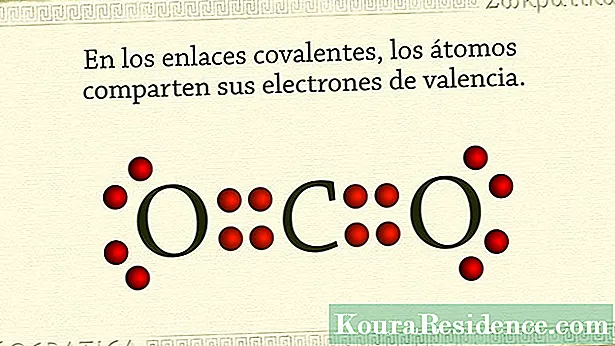
Yn nodweddiadol, bondiau cofalent yw'r rhai hynny dal atomau anfetelaidd gyda'i gilydd. Mae'n digwydd bod gan atomau'r elfennau hyn lawer o electronau yn eu plisgyn allanol ac mae ganddynt dueddiad i gadw neu ennill electronau, yn lle eu rhoi i fyny.
Dyna pam y ffordd y mae'r sylweddau neu'r cyfansoddion cemegol hynmae icos yn sicrhau sefydlogrwydd yw trwy rannu pâr o electronau, unid o bob atom. Yn y modd hwn mae'r pâr o electronau a rennir yn gyffredin i'r ddau atom ac ar yr un pryd yn eu dal gyda'i gilydd. Yn y nwyon uchelwyr, er enghraifft, mae hyn yn digwydd. Hefyd mewn elfennau halogen.
Pan fydd y bond cofalent yn digwydd rhwng elfennau o electronegatifedd tebyg, megis rhwng hydrogen a charbon, cynhyrchir bond cofalent apolar. Mae hyn yn digwydd, er enghraifft, mewn hydrocarbonau.
Yn yr un modd, mae moleciwlau homoniwclear (sy'n cynnwys yr un atom) bob amser yn ffurfio bondiau apolar. Ond os yw'r bond yn digwydd rhwng elfennau o wahanol electronegatifedd, cynhyrchir dwysedd electron uwch mewn un atom nag mewn un arall, o ganlyniad i hyn mae polyn yn cael ei ffurfio.
Trydydd posibilrwydd yw bod dau atom yn rhannu pâr o electronau, ond mai dim ond un atom ohonynt sy'n cyfrannu at yr electronau a rennir hyn. Yn yr achos hwnnw rydym yn siarad am bond cofalent dative neu gydlynu.
Am dolen dative mae angen elfen gyda phâr electron rhad ac am ddim (fel nitrogen) ac un arall sy'n brin o electronau (fel hydrogen). Mae hefyd yn angenrheidiol bod yr un gyda'r pâr electronig yn ddigon electronegyddol i beidio â cholli'r electronau i'w rhannu. Mae'r sefyllfa hon yn digwydd, er enghraifft, mewn amonia (NH4+).
Mae'r sylweddau gall cynnwys cyfansoddion cofalent ddigwydd mewn unrhyw gyflwr (solid, hylif neu nwyol), ac yn gyffredinol maent yn ddargludyddion gwres a thrydan gwael.
Maen nhw'n dangos yn aml pwyntiau toddi a berwi cymharol isel a fel arfer yn hydawdd mewn toddyddion pegynol, fel bensen neu tetraclorid carbon, ond mae hydoddedd gwael mewn dŵr. Maent yn hynod sefydlog.
Gellir rhoi nifer o enghreifftiau o gyfansoddion neu sylweddau sy'n cynnwys bondiau cofalent:
- Fflworin
- Bromine
- Ïodin
- Clorin
- Ocsigen
- Dŵr
- Carbon deuocsid
- Amonia
- Methan
- Propan
- Silica
- Diemwnt
- Graffit
- Chwarts
- Glwcos
- Paraffin
- Diesel
- Nitrogen
- Heliwm
- Freon