Nghynnwys
Gydag enw atom isafswm uned y elfennau cemegol, sydd â'i fodolaeth ei hun ac sydd hefyd yn anwahanadwy. Yr atom yw gronyn sylfaen yr holl fater hysbys, ac mae'n bresennol ym mhob peth, mewn bodau byw yn ogystal ag mewn gwrthrychau anadweithiol.
Nodweddu atom anwahanadwy Nid oherwydd amhosibilrwydd yr atom yn cael ei hollti, ond yn hytrach yn achos ei hollti byddai'n colli ei priodweddau cemegol: mae'r atom mewn gwirionedd yn cynnwys gronynnau llai fyth, yr hysbys gronynnau isatomig.
Cyfansoddiad
Mewn gwirionedd, mae cyfansoddiad yr atom yn cynnwys canolfan sy'n cynnwys niwclews sy'n cynnwys protonau a niwtronau, a sawl plisgyn allanol sydd â'r gronynnau isatomig lleiaf o atomau, yr electronau.
Tra bod y electronau cael gwefr negyddol, protonau gwefr drydan gyfartal ond positif a'r niwtronau does dim tâl arnyn nhw. Datblygwyd y model gwefrau a haenau trydan gan Bohr, ac mae'n gweithio'n dda i esbonio'r bondiau rhwng y gwahanol atomau.
Priodweddau
Mae gan yr atom rai priodweddau bob amser, sy'n ddefnyddiol i ddeall y grwpiau maen nhw'n eu gwneud yn ogystal â'r sefydliadau amrywiol. Mae gan yr atom bob amser a rhif atomig (a gynrychiolir gan y llythyr Z.) sy'n egluro nifer y protonau sydd ynddo, sy'n hafal i nifer yr electronau. Mae ganddo hefyd a rhif màs, a gynrychiolir gan y llythyr I, sy'n cyfeirio at swm y protonau a'r niwtronau y mae'r elfen yn eu cynnwys yn ei niwclews.
Dosbarthiad
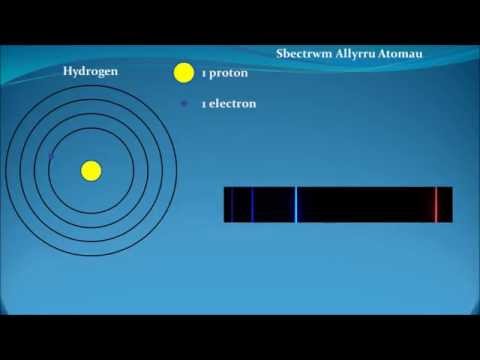
Mae yna wahanol ddosbarthiadau o atomau, a'r dosbarthiad mwyaf cyffredin yw'r un a wneir yn y tabl cyfnodol o'r elfennau, sy'n rhannu'r atomau yn ôl eu rhif atomig: yr unig elfen sydd ag un proton yn y niwclews yw hydrogen.
Mae'r elfennau hyn hefyd fel arfer yn cael eu dosbarthu ymhlith y metelau, sydd â thueddiad i golli electronau o'u plisgyn olaf ac yna i ffurfio'r hyn a elwir yn ïonau positif, o'r dim metelau i'r gwrthwyneb, derbyn electronau yn ei haen olaf gan ffurfio ïonau negyddol.
Hanes Theori Atomig
Mae'r theori atomig mae deall yr elfennau hyn fel uned leiaf strwythur mater wedi bodoli ers Gwlad Groeg Hynafol, ac yn ychwanegol at Bohr Roedd yn cynnwys nifer fawr o gemegwyr yn cyfrannu cwestiynau ynghylch yr astudiaeth.
Yn 1803, John dalton Modelodd yr atom trwy ddangos bod yr undeb rhyngddynt wedi'i wneud trwy rai cynigion pendant. Penderfynodd John Thomson, o'i ran ef, y gwefrau positif a negyddol a chydffurfiad ïonau'r ddau arwydd. Y nesaf ymhlith rhagflaenwyr Bohr oedd Rutherford, a oedd yn cyfrif am gwestiwn gwahanol lefelau a haenau electronig.
Dilynodd y modelau ei gilydd tan astudiaethau cyfredol y Damcaniaeth cwantwm, yn ganolog i'r caeau yn bennaf. Yn amlwg, mae'n sicr bod strwythur y niwclews atomig a'r gronynnau sy'n ei ffurfio yn llawer mwy cymhleth na strwythur electronig traddodiadol atomau.
Nesaf, y rhestr gyflawn o elfennau'r tabl cyfnodol, sy'n gyfystyr â chyfanrwydd yr atomau cyfansoddedig.
| Actinium | Dysprosiwm | Magnesiwm | Rhodiwm |
| Alwminiwm | Dubnium | Manganîs | Roentgenio |
| Americium | Einsteinium | Meitnerius | Rubidium |
| Antimoni | Erbium | Mendelevium | Ruthenium |
| Argon | Scandium | Mercwri | Rutherfordio |
| Arsenig | Tun | Molybdenwm | Samariwm |
| Astatus | Strontiwm | Neodymiwm | Seaborgio |
| Sylffwr | Europium | Neon | Seleniwm |
| Bariwm | Fermium | Neptunium | Silicon |
| Beryllium | Flerovio | Niobium | Sodiwm |
| Berkelium | Fflworin | Nickel | Thallium |
| Bismuth | Cydweddiad | Nitrogen | Tantalwm |
| Bohrio | Francius | Nobelio | Technetium |
| Boron | Gadolinium | Aur | Tellurium |
| Bromine | Gallium | Osmium | Terbium |
| Cadmiwm | Germanium | Ocsigen | Titaniwm |
| Calsiwm | Hafnium | Palladium | Thorium |
| Californium | Hassio | Arian | Thulium |
| Carbon | Heliwm | Platinwm | Ununoctium |
| Cerium | Hydrogen | Arwain | Ununpentium |
| Cesiwm | Haearn | Plwtoniwm | Ununseptio |
| Sinc | Holmium | Poloniwm | Ununtrium |
| Zirconium | Indiaidd | Potasiwm | Wraniwm |
| Clorin | Iridium | Praseodymium | Fanadiwm |
| Cobalt | Krypton | Addewid | Twngsten |
| Copr | Lanthanum | Protactinium | Xenon |
| Copernicus | Lawrencio | Radio | Ïodin |
| Chrome | Lithiwm | Radon | Yterbium |
| Curiwm | Livermorio | Rhenium | Ytrio |
| Darmstadtium | Lutetium |


